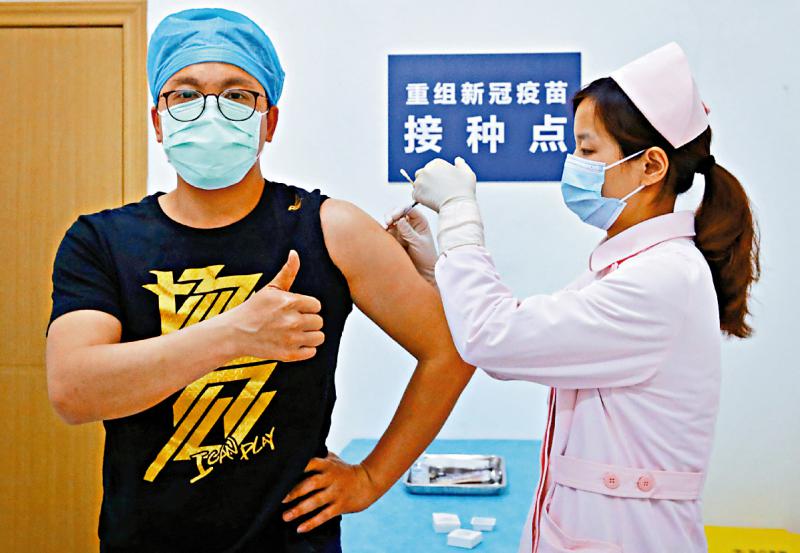
图:图为陈薇团队研发人员安排一位志愿者在武汉接种疫苗\网络图片
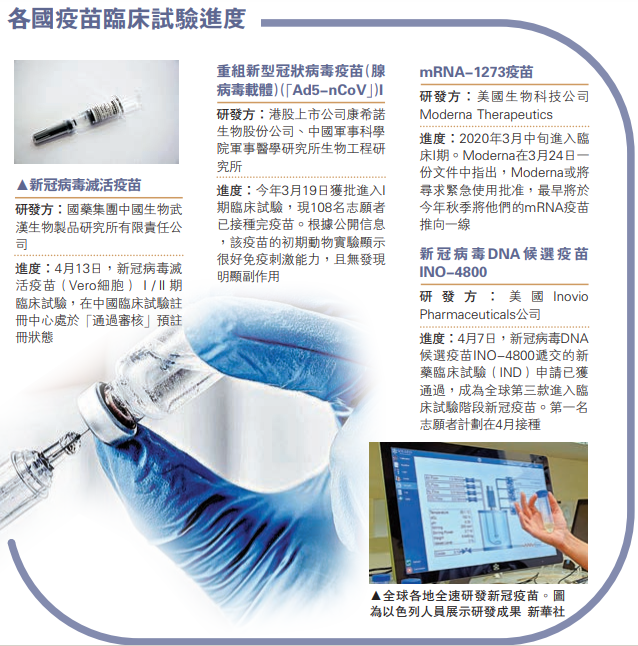
新冠疫情全球爆发,各国争分夺秒研发疫苗。中国的新冠病毒疫苗研发日前再传喜讯,军事科学院军事医学研究所生物工程研究所陈薇院士团队牵头研发的重组新冠病毒(腺病毒载体)疫苗研发工作再下一城,与此同时,国药集团、北京科兴控股两家企业的新冠病毒灭活疫苗亦进入I期临床阶段。据介绍,国药集团共安排10亿(人民币,下同)资金在武汉和北京研发疫苗,这是全球首家获得临床试验批件的新冠病毒灭活疫苗,具有生产工艺成熟、质量标准可控、保护范围广等优点,可用于大规模接种。\大公报记者 刘凝哲北京报道
新冠疫情发生后,中国立即启动疫苗研发计划,沿着五条疫苗技术路线全力推进。官方将此称为疫苗研发的“挂图作战”,对疫苗研发集中优势、不计成本。据报道,流行病防范创新联盟(CEPI)的7位研究人员在《Nature Review Drug Discover》期刊上发表文章,对正在研发的115个针对新冠肺炎的候选疫苗项目进展进行介绍。文章称,截至4月8日,研发速度最快的5种候选疫苗已经进入到临床试验阶段,中国占3项。除陈薇团队的重组新冠病毒疫苗项目外,还有深圳市免疫基因治疗研究院的LV-SMENP-DC和具病原特异性的aAPC。

接种刺激机体 产生免疫应答
两家中国企业在新冠病毒灭活疫苗研发上更近一步。据报道,国药集团中国生物武汉生物制品研究所有限责任公司研发的新型冠状病毒(COVID-19)灭活疫苗(Vero细胞)Ⅰ/Ⅱ期临床试验在中国临床试验注册中心正处于“通过审核”预注册状态。这意味着,中国又一款新冠肺炎疫苗将进入临床试验阶段。
“灭活疫苗”由完整病毒组成,其致病性丧失仍然保持病毒的全部或部分免疫原性,接种后病毒抗原可以刺激机体产生免疫应答,达到保护作用。在研制生产方面,研究人员在合适的细胞上培养筛选毒株,获得代表病毒抗原特征、滴度较高并且稳定的病毒,用于建立作为以后大规模生产疫苗的种子库。然后,通过培养、灭活、提纯等过程制备候选疫苗,工艺较为简单,为传统经典的疫苗制备方式。

不过,“灭活疫苗”研发也遇上困难,由于医学目前对于新冠病毒的致病机理和免疫学机制的研究尚不深入,灭活全病毒有可能携带有害成分。此外,目前活病毒培养要求在P3级生物安全条件下进行,产能会受到限制。
13日,国家药品监督管理局已批准旗下北京科兴中维生物技术有限公司研制的新型冠状病毒灭活疫苗“克尔来福”进入临床研究。据报道,科兴曾开展过SARS疫苗的研究,并完成I期临床试验。此次开展新冠疫苗研究,科兴中维从3月13日起先后向国家药监局药品审评中心(CDE)滚动提交了17轮申报资料。10日晚间,科兴团队曾向以钟南山院士为组长的联防联控机制科研攻关组的大专家组汇报方案。12日,科兴中维向CDE正式提出临床试验申请,并在不久后获得批准。

陈薇团队疫苗率先全球进入Ⅱ期试验
综合记者刘凝哲、澎湃新闻报道:4月12日,由军事科学院军事医学研究所生物工程研究所陈薇院士团队牵头研发的重组新冠病毒(腺病毒载体)疫苗Ⅱ期人体临床试验正式在武汉开始受试者接种试验。这是全球首款进入Ⅱ期人体临床试验的新冠病毒疫苗。
4月13日上午,84岁高龄的武汉老人熊正兴在女儿熊英的陪同下完成了重组新冠病毒疫苗的接种,成为目前全球首个新冠病毒疫苗Ⅱ期临床试验中年龄最高的志愿者。
注重有效性 规模超500人
重组新冠病毒(腺病毒载体)疫苗采用基因工程方法构建,以复制缺陷型人5型腺病毒为载体,可表达新型冠状病毒S抗原,用于预防新型冠状病毒感染引起的疾病。
据悉,疫苗的Ⅰ期人体临床试验注重安全性,而Ⅱ期人体临床试验则注重有效性。与Ⅰ期试验不同,Ⅱ期临床试验规模更大,多达500人,且引入了安慰剂对照组。在Ⅱ期人体临床试验中,志愿者无需接受14天的集中观察,只需自行完成安全性观察即可。在此期间,研究组会派专人对志愿者进行随访,指导其完成安全性观察和记录。