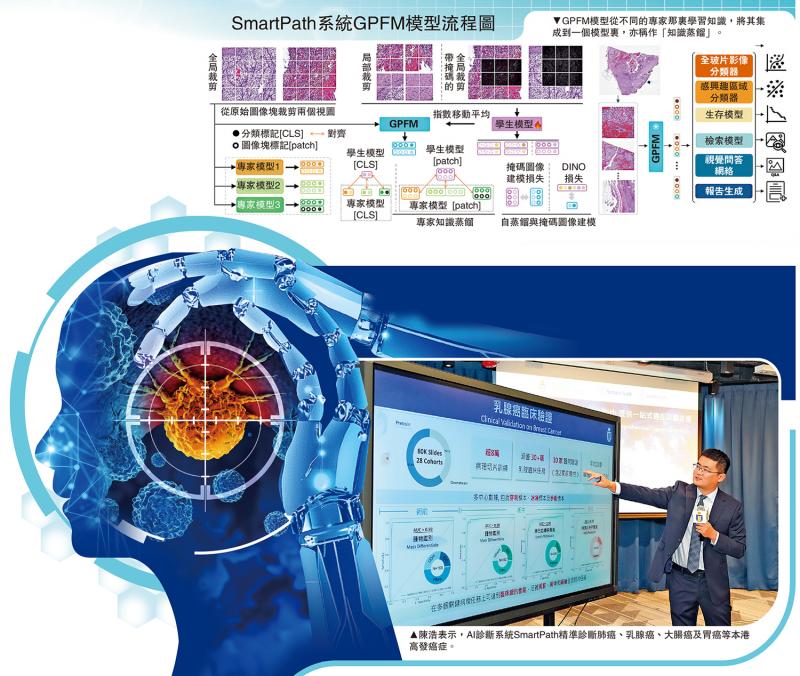
上图:GPFM模型从不同的专家那里学习知识,将其集成到一个模型里,亦称作“知识蒸馏”。下图:陈浩表示,AI诊断系统SmartPath精准诊断肺癌、乳腺癌、大肠癌及胃癌等本港高发癌症。
癌症诊断需时,需要准确的判断力,然而本港医护人手不足,如何在应付日常繁重的工作下,令癌症患者能够及时就诊,成为本港医院恒常的挑战。
面对这一困境,全新人工智能(AI)诊断系统SmartPath应运而生。SmartPath由香港科技大学开发、在广州南方医院做前瞻性临床验证,项目团队负责人日前接受《大公报》专访时介绍,SmartPath在癌症诊断的术前、术中和术后诊断中表现出0.98-0.99的高准确度;且该AI模型完成一次诊断仅需约一分钟,相较原先几分钟至十几分钟的人工诊断时间,效率大幅提升。团队希望半年至一年后,能令SmartPath市场化。\大公报记者 邱梓茵、汤嘉平(文) 林少权(图)
SmartPath系统研发者、香港科技大学计算机科学及工程学系和化学及生物工程学系助理教授兼医工交叉联合创新中心主任陈浩介绍,该系统建基于全球规模最大、种类最多元的病理数据库之一,涵盖34个主要人体组织部位,收录逾50万张全切片影像。系统可协助医护人员完成逾百项临床任务,包括癌症分级分型、治疗反应评估、存活率预测及生成病理报告,并实现关键突破:透过综合病理基础模型框架,精准诊断肺癌、乳腺癌、大肠癌及胃癌等高发癌症。“在众多检查方法中,组织病理学检查是癌症诊断的金标准,可用于最终诊断及指导治疗。”陈浩说道。
病理数据全球规模最大
SmartPath的核心技术由GPFM与mSTAR两大AI模型协同驱动。病理诊断本质上是对切片影像的精读,GPFM如同显微镜下的“导航员”,能将复杂视觉信号转化为可判读的线索。为训练此模型,研发团队与南方医科大学梁莉教授等临床专家共建约10万张病理切片的“图谱级”资料库,覆盖术前活检诊断、术中切缘判断及术后评估三大关键场景,实现诊疗全流程覆盖。
陈浩进一步解释,GPFM模型采用“知识蒸馏”技术(见SmartPath系统GPFM模型流程图),其中“教师模型”如资深病理专家,能全面预测并标注病变类型与概率;“学生模型”则如初入行的年轻医生,透过学习教师模型的诊断思路,掌握数据规律并提升判断能力。此方法不仅提高模型的泛化能力,使其在未见过的病人数据上表现更佳,还能加速训练过程,提升效率。
为应对复杂的癌症诊断需求,团队另研发多模态基础模型mSTAR。该模型如同“综合诊断专家”,不仅能解读病理切片的视觉信息,更能融合病理报告、基因分子数据等多元信息,透过“多模态知识增强”技术形成完整诊断依据。陈浩强调:“mSTAR是全球首个多模态知识增强的泛癌病理基础大模型。”该模型大幅扩展应用场景,涵盖癌症诊断及预后评估等多项临床任务。
SmartPath在完成开发后、大规模试用前进行了前瞻性临床验证,以评估其稳定性与临床适用性。参与验证的南方医院病理科主任、南方医科大学基础医学院病理学系教授梁莉指出,该系统在术前、术中和术后诊断中均表现高准确度,接近“零误判”。陈浩也表示,正持续纳入多样化数据,以适应各地不同的临床需求。
与内地多家重点医院合作
在术前诊断方面,系统良恶性分类的AUC值高达0.99,几乎无误判。梁莉表示,AI模型完成一次诊断仅需约1分钟,相比传统人工分析,效率显著提升,有助于缩短患者等待时间,并降低不必要的手术风险。
术中冰冻诊断要求在30分钟内出具结果,直接影响手术方案。验证中,AI系统对术中冰冻标本的良恶性分类准确度达0.99,诊断时间缩短30%以上,有助于医生优化手术决策,降低因诊断延误或偏差带来的风险。
针对术后标本,系统进一步扩展应用,涵盖肿瘤分型、分子标志物预测、淋巴结转移判断及癌栓检测等多项任务。在肺癌原发与转移灶的鉴别及来源预测中,分类准确度达0.98。临床数据显示,系统可将医生诊断精准度提升10%以上,在复杂病例中尤其能够减轻医生负担,降低人为误差。
陈浩补充,研发与验证阶段已与全国上百家医院合作,其中十馀家重点医院参与了回顾性与前瞻性研究,覆盖多个省份与医疗体系。他强调,联动不同区域医院的核心目的,是纳入多样化人口结构与病例数据,以确保AI模型在后续推广中更好地适应各地临床实验。